مقالات
ساختار باتری ماشین
ساختار باتری ماشین
باتری های سرب اسید 12 ولتی، این باتری های بزرگ و نسبتا سنگین در تمامی خودروهای با موتور احتراقی استفاده می شوند. باتری ها عضو ضروری و جدا نشدنی خودروها هستند. بنابراین باید بدانیم ساختار باتری خودرو به چه صورت است، چه کاری انجام می دهند یا چگونه ساخته می شوند؟
باتری ماشین چیست؟
باتری 12 ولتی خودرو چیزی شبیه به تصویر زیر است.

باتری که در تصویر نشان داده شده یک باتری سرب اسید است و به این علت به آن سرب اسید می گویند که داخل آن صفحات سربی در وجود دارد که در اسید غوطه ور هستند و با ایجاد یک واکنش شیمیایی باعث آزاد شدن انرژی شده و ولتاژ و جریان را فراهم می کنند.
باتری انرژی را به صورت انرژی شیمیایی ذخیره می کند نه برق. این انرژی شیمیایی هروقت که به آن احتیاج داشته باشیم به انرژی الکتریکی تبدیل می شود. همچنین باتری خودرو قابل شارژ است و در صورتی که برق مورد نیاز آن را تامین کنیم می توانیم با معکوس کردن واکنش شیمیایی باتری را شارژ کنیم. باتری خودرو می تواند جریان زیادی را نسبت به باتری های معمولی, کوچکتر و باتری های خانگی تولید کند.
چرا در خودروها از باتری استفاده میکنیم؟
باتری ها معمولا در جلوی ماشین و در کنار موتور قرار دارند. وظیفه اصلی باتری خودرو راه اندازی موتور است که این کار را با تامین برق یک موتور الکتریکی کوچک به نام موتور استارت انجام می دهند. همچنین برای شروع احتراق سوخت، برق را به سیستم جرقه زنی می دهد.
استارتر یک دنده کوچک را روی فلایویل موتور درگیر می کند. این کار را انجام می دهد تا میل لنگ را بچرخاند که موتور احتراقی را روشن می کند، دنده کوچک سپس جدا می شود و موتور خود به خود کار می کند. استارتر برای اینکه بتواند فلایویل را بچرخاند به نیروی زیادی نیاز دارد، بنابراین استارتر جریان بسیار زیادی را، احتمالاً صدها آمپر، فقط برای چند ثانیه نیاز دارد. این جریان زیاد انرژی ذخیره شده در باتری را کاهش می دهد. بنابراین باید آن را بار دیگر تامین کنیم. برای اینکار از دینام استفاده می شود. دینام به موتور خودرو متصل است و توسط موتور به گردش درمی آید و باعث تولید برق و شارژ باتری می شود. باتری خودرو هنگامی که خودرو روشن است از طریق اضافه تولید دینام شارژ می شود. و هنگام نیاز مثلا هنگام استارت زدن این شارژ برای تامین انرژی الکتریکی خودرو مصرف شده و اصطلاحا باتری دشارژ می شود. در صورتی که کل مصرف الکتریکی خودرو بیشتر از انرژی تولید شده از خودرو باشد باتری نیز برای تامین مصرف الکتریکی خودرو خالی می شود.
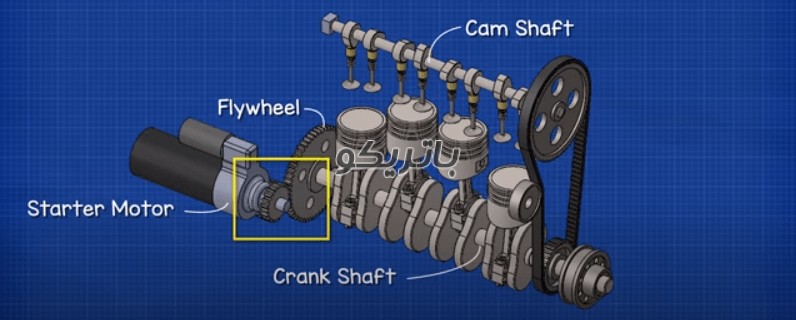
در حالی که موتور در حال کار است، دینام باتری را دوباره شارژ می کند و انرژی الکتریکی مواردی مانند سیستم روشنایی و موسیقی را نیز تامین می کند. زمانی که تقاضا برای برق بیشتر از چیزی باشد که دینام می تواند تامین کند، باتری نیروی اضافی را تامین می کند که در این صورت باز هم انرژی باتری تخلیه می شود.
زمانیکه موتور خاموش می شود, دینام چرخش و شارژ باتری را متوقف می کند. در این حالت باتری انرژی تمامی قطعات را تامین میکند تا زمانی که کاملا تخلیه شود. در این صورت دیگر توانایی لازم برای راه اندازی موتور و استارت خودرو را ندارد. برای شارژ مجدد باتری می توانیم از روش باتری به باتری استفاده کنیم.
ساختار باتری سرب اسید
برای درک بهتر عملکرد باتری، لازم است اجزای اصلی آن را بشناسیم.
- پایانه باتری: پایانه ها به بند مثبت و بند منفی سلول های انتهایی متصل می شوند و نقطه واسط بین باتری و سیستم الکتریکی خودرو هستند.
- اسید باتری: اسید باتری محلولی با خلوص بالا از اسید سولفوریک و آب است.
- اتصال دهنده سلول های مثبت و منفی: اتصال دهنده ها به بالای هر یک از مجموعه صفحات جوش داده می شوند تا اتصال الکتریکی به پایانه ها برقرار شود.
- صفحه منفی باتری: صفحه منفی حاوی یک شبکه فلزی با مواد فعال سرب است.
- جداکننده باتری: جداکننده یک ماده پلی اتیلن است که صفحات مثبت را از صفحات منفی جدا می کند تا جریان الکتریکی کارآمدی ایجاد کند.
- صفحه مثبت باتری: صفحه مثبت حاوی یک شبکه فلزی با مواد فعال دی اکسید سرب است.
- درب باتری: درب باتری از رزین پلی پروپیلن ساخته شده و به قاب باتری بسته شده است.
- قاب باتری: کیس از رزین پلی پروپیلن است که صفحات باتری، اتصال دهنده سلول ها و الکترولیت را نگه می دارد. برای به حداقل رساندن تاثیر لرزش و افزایش عمر باتری طراحی شده است.
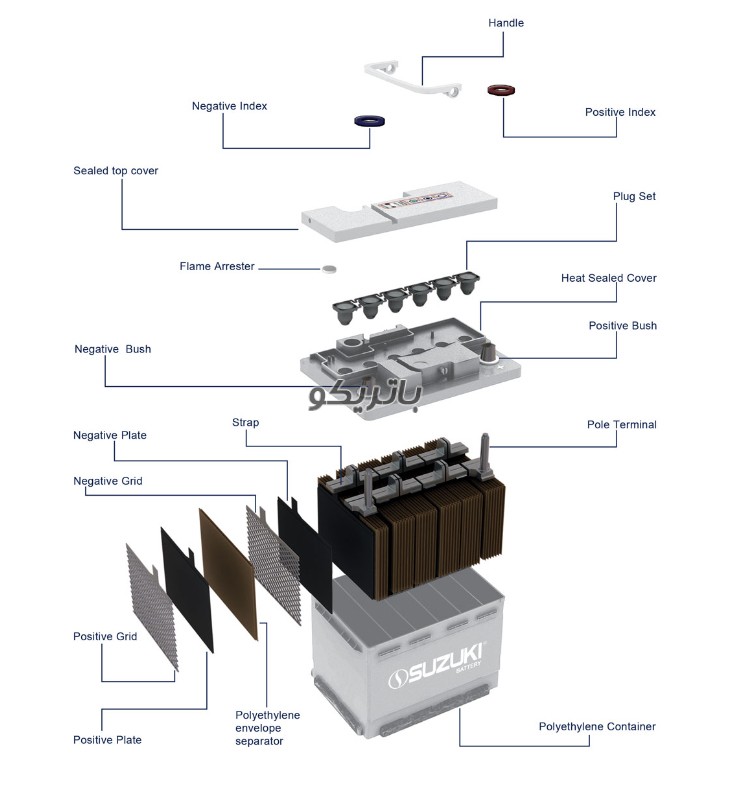
برای توصیف دقیق اجزای باتری، در ابتدا ما یک قاب پلاستیکی داریم که تمام اجزای داخلی را در جای خود نگاه می دارد و باید در مقابل حرارت حاصله از فعل و انفعالات شیمیایی باتری و ضربه مقاوم باشد. در قسمت بالایی قاب یک درپوش پلاستیکی داریم و دو ترمینال مثبت و منفی که به آنها پایه ترمینال می گویند.
با برداشتن درپوش می توانیم داخل باتری را مشاهده کنیم. بدنه باتری به 6 محفظه جداگانه تقسیم شده است که هر کدام توسط یک دیوار پلاستیکی از هم جدا شده اند. هر اتاقک به عنوان یک سلول شناخته می شود. هر سلول حدود 2.1 ولت DC یا جریان مستقیم تولید می کند. سلول ها به صورت سری به یکدیگر متصل اند، سر منفی یک سلول به سر مثبت سلول بعدی متصل می شود تا ولتاژ کل حدود 12.6 ولت به ما بدهد. در هر سلول صفحه ای سربی قرار دارد که از طریق دیواره های پلاستیکی به یکدیگر جوش داده شده اند و بهم متصل اند.
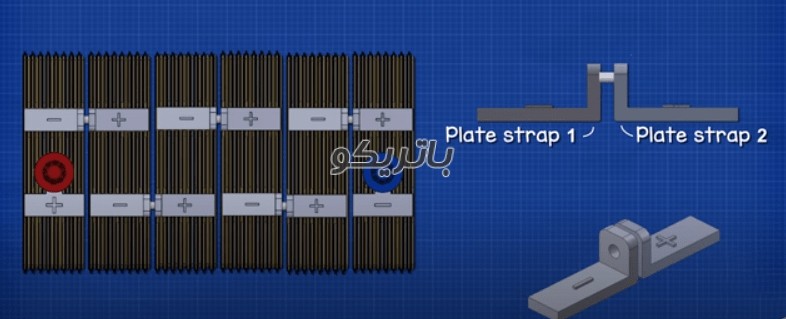
با توضیحاتی که تا کنون داده ایم جریان از طریق سلول های باتری از مثبت به منفی می گذرد و طبق نظریه جریان ها این یک پدیده کاملا عادی است. اما آنچه در واقع اتفاق می افتد این است که الکترون ها در جهت مخالف از منفی به مثبت جریان می یابند.
در هر سلول دو صفحه مثبت و منفی وجود دارد که بین این صفحات یک صفحه عایق قرار گرفته است. صفحه منفی آند است که صفحه ای مشبک و دارای جنسی از سرب خالص است، اگرچه مقادیر کمی از مواد افزودنی برای سفت شدن سرب و محافظت از آن در برابر خوردگی اضافه می شود. صفحه مثبت یا کاتد نیز صفحه ای مشبک است که از جنس پراکسید سرب است. جنس غیر مشابه صفحات باعث ایجاد واکنش شیمیایی و آزاد کردن الکترون ها می شود.
تماس صفحات مثبت و منفی باعث ایجاد اتصال کوتاه باتری می شود، برای جلوگیری از این مشکل صفحه عایقی بین دو صفحه مثبت و منفی قرار داده اند. صفحات عایق از جنس پلی اتیلن یا فیبر ساخته می شود. این صفحات از یک طرف صاف و از طرف دیگر دارای برجستگی هستند. برجستگی صفحه عایق ذرات جدا شده از صفحه مثبت را به ته باتری هدایت کرده و از اتصال کوتاه صفحات جلوگیری می کند.
درون هر سلول از مایع الکترولیت اسید سولفوریک و آب پر می شود. از نظر علمی اسید به عنوان یک کاتالیزور عمل می کند. این اسید بر روی صفحه دی اکسید سرب واکنش ایجاد می کند و باعث می شود صفحه دو چیز تولید کند: یون و سولفات سرب.
یون های تولید شده توسط صفحه دی اکسید سرب به صفحه مجاور واکنش می دهند تا هیدروژن و سولفات سرب تولید کنند. نتیجه یک واکنش شیمیایی است که الکترون تولید می کند. الکترونها در اطراف صفحات می چرخند و برق تولید می کنند. برق برای استارت موتور، روشن کردن چراغ های جلو و پخش رادیو از پایانه های باتری خارج می شود.
این واکنش شیمیایی کاملاً برگشت پذیر است، به این صورت که انرژی شیمیایی به انرژی الکتریکی در زمان دشارژ یا تخلیه ی باطری و انرژی الکتریکی به انرژی شیمیایی در زمان شارژ یا پرشدن باطری، تبدیل میشود.
ساختار باتری خودرو را در ویدیو زیر می توانید به صورت کامل مشاهده نمایید.
نحوه عملکرد باتری ماشین
باتری ماشین انرژی را به شکل شیمیایی ذخیره می کند و آن را به انرژی الکتریکی تبدیل می کند. در این فرآیند الکتروشیمیایی، چهار ماده با یکدیگر واکنش می دهند:
- هیدروژن H
- اکسیژن O2
- سرب Pb
- گوگرد S
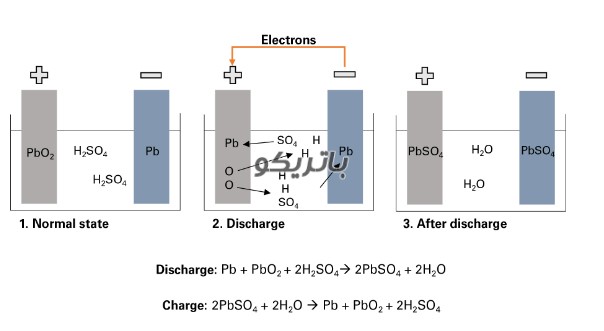
اتصال یک مصرف کننده خارجی باعث شروع واکنش شیمیایی در باتری می شود:
الکترولیت که مخلوطی از اسید سولفوریک (H2SO4) و آب مقطر است، به یون های هیدروژن با بار مثبت (H+) و یون های سولفات با بار منفی (SO42-) تجزیه می شود.
در همین زمان، الکترون ها (-2e) از طریق مصرف کننده خارجی از الکترود منفی به مثبت می روند.
برای جبران این جریان الکترونها، یونهای سولفات از الکترولیت به الکترود منفی میروند و در آنجا با سرب (Pb) واکنش داده و سولفات سرب (PbSO4) تولید میکنند.
سولفات سرب نیز در الکترود مثبت تولید می شود: پیوند اکسیژن (O2) در اکسید سرب (PbO2) با انتقال الکترون ها شکسته می شود و اکسیژن به الکترولیت می رسد. سرب باقیمانده (Pb) با سولفات (SO4) از الکترولیت پیوند مییابد.
در آنجا، اکسیژن با هیدروژن پیوند برقرار می کند و آب (H2O) را تشکیل می دهد. همانطور که اسید سولفوریک با تشکیل سولفات سرب مصرف می شود، غلظت محلول الکترولیت کاهش می یابد. هنگامی که غلظت اسید سولفوریک به زیر سطح معینی میرسد، باتری باید دوباره شارژ شود.
در طول شارژ، فرآیندهای شیمیایی به ترتیب معکوس انجام می شود. در پایان، عناصر اصلی را که می توان یافت: الکترود مثبت از سولفات سرب (PbSO4)، الکترود منفی از سرب خالص (Pb) و الکترولیت از اسید سولفوریک رقیق (H2SO4) تشکیل شده است. از آنجایی که این فرآیند تبدیل با تلفات همراه است، باتری فقط می تواند تعداد محدودی از چرخه های شارژ را تحمل کند. بنابراین عمر مفید آن محدود است.
برای اطلاعات بیشتر می توانید مقاله نشانه های ضعیف شدن باتری خودرو را مطالعه نمایید.
مشکلات باتری لید اسید
یکی از مهترین مشکلات باتری های لید اسید، سولفاته شدن و لایه بندی محلول اسیدی آن است.
اگر باتری با ولتاژ بسیار کم شارژ شود، یا اگر همیشه با ولتاژ بسیار پایین (زیر 80 درصد) کار کند، لایهبندی اسیدی رخ میدهد. اسید موجود در الکترولیت به دلیل ضعف در ترکیب لایه لایه می شود. چگالی های مختلف باعث لایه لایه شدن اسید سولفوریک در قسمت پایین و آب در قسمت بالایی باتری می شود. به همین دلیل، تنها بخش میانی الکترولیت، یعنی فقط یک سوم، می تواند برای فرآیند تخلیه و شارژ استفاده شود.

یکی از دلایل احتمالی لایه بندی اسید عمدتاً سفرهای کوتاه با استفاده همزمان از تعداد زیادی مصرف کننده برقی است. در این حالت دینام زمان کافی برای شارژ مجدد باتری را ندارد.
لایه بندی اسیدی باتری خودرو به تدریج باعث سولفاته شدن باتری می گردد. سولفاته شدن از تبدیل مجدد سولفات سرب به اجزای اصلی سرب یا اکسید سرب جلوگیری می کند که منجر به جلوگیری از پذیرش شارژ و کاهش قدرت باتری می شود.
وظیفه باتری ماشین
باتری به طور کلی وظیفه تامین انرژی قطعات الکتریکی خودرو را بر عهده دارد و این انرژی را از طریق دینام تامین می کند. اما مهمترین وظایف این قطعه به شرح زیر است:
- ذخیره انرژی اضافی تولید شده و استفاده از آن در مواقع لازم
- تامین انرژی لازم برای استارت خودرو
- تامین انرژی برق چراغ ها و سایر لوازم برقی خودرو مانند سیستم پخش و سیستم تهویه